안녕하세요~ 꾸둥이 입니다!
오늘은 신약, TRL 그리고 의약품 연구개발의 단계가 어떻게 되는지에
대해서 아주 간략하게 설명 드리려고 해요.
저도 초보라 최대한 쉬운내용만 가져왔으니까 함께 잘 공부해보아요.

화이팅 입니다!
먼저 신약이란 무엇일까요?
신약이란, 화학구조나 본질구성이 전혀 새로운 신물질의약품 또는 신물질을 유효성분으로 함유한 복합 제제 의약품으로 식품의약품 안전처장이 지정하는 의약품을 말합니다! (약사법 제 2조 8항)
그럼 이런 신약, 바이오를 개발할때는 어떤 단계를 거치는지 알아보도록해요.
의약품 연구개발의 단계를 알기전에
TRL 이라는 단계에 대해서 먼저 설명 드릴게요.
TRL 이란? Technology Readiness Level, 기술성숙도 라는 것인데요.
다양한 기술의 연구개발 단계를 체계적으로 분류할 공통 기준을 제정하려는 노력으로 탄생하게 된 기준입니다.
미국의 NASA 같은 곳에서도 TRL 단계를 활용하고 있다고 해요.
즉, 연구 개발의 세계적 기준이라고 보면 편하실거에요.
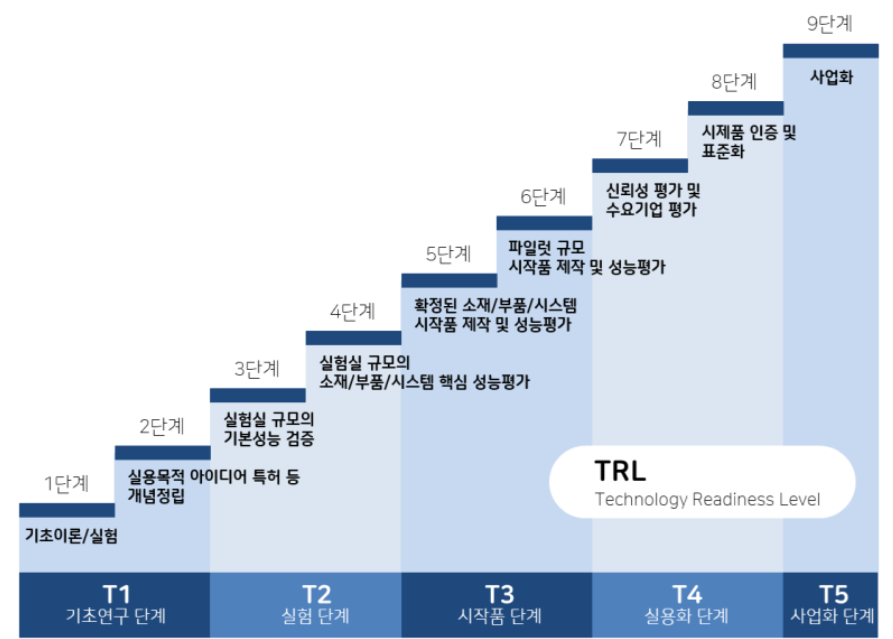
(단계를 보면 비임상 단계가 TRL 6단계, 임상1~2상이 7단계, 임상3상이 8단계와 유사함을 볼 수 있어요)
그럼 의약품 연구개발의단계는
어떻게 되는지 알아볼게요
연구/개발 → 비임상(약리/독성) → 임상(1~2상) → 임상(3상) → 제품허가 → 생산판매
간단하게 이렇게 볼 수 있는데요,
연구/개발에서는 R&D 계획과 시험관 연구를 하며, 이때는 실험실 안전규정을 준수하고,
GLP 규정에 맞게 시행하게 됩니다.
비임상(약리/독성) 단계는 동물 실험을 시행하며 GLP 규정에 맞게 시행하게 됩니다.
임상(1~2상) 단계에서는 임상시험을 설계하고, IRB 심의를 거치며 연구수행, 피험자 보호, 통계 등의 작업을 합니다. 임상단계에서는 GCP 규정에 맞게 시행하게 됩니다. 1상에서는 임상약리 시험을 하고,
2상에서는 치료적 유효성을 탐색하며 가능한 용량과 투여기간을 설정하며 다양한 정보수집을 하게 됩니다.
임상(3상) 단계에서는 기존 치료와 비교하며 의약품의 안전성과 유효성을 확증하기 위해 시행되며
GCP 규정에 맞게 시행하게 됩니다.
제품허가 단계에서는 식약처 승인을 받아 제품 허가를 받게되고, 그 후 생산 판매를 진행하게 됩니다.
생산판매 시에는 제조시설이 GMP 규정에 적합한지를 보게 됩니다.
그럼 대체, GLP・GMP・GCP 등이 어떤걸 말하는 걸까요?
GLP・GMP・GCP 에 관해서는 다음 글에서 간략하게 설명 드리겠습니다!
다음글에서 만나요

초보 CRA의 공부기록이라 최대한 쉽고 기초적인 내용을 기록하고 있어 내용이 부족할 수 있습니다.
변동된 사항이나 잘못된 점이 있다면 언제든 알려주시면 감사하겠습니다 (✿◡‿◡)
'꾸둥이의 CRA 공부' 카테고리의 다른 글
| CRA 업무_임상시험 모니터링 MONITORING (0) | 2022.05.03 |
|---|---|
| GLP・GMP・GCP 란 무엇일까? (0) | 2022.04.29 |
| [온라인] 2022년 GCP 신규자 과정_TEST 문제 리스트(답X) (0) | 2022.04.29 |